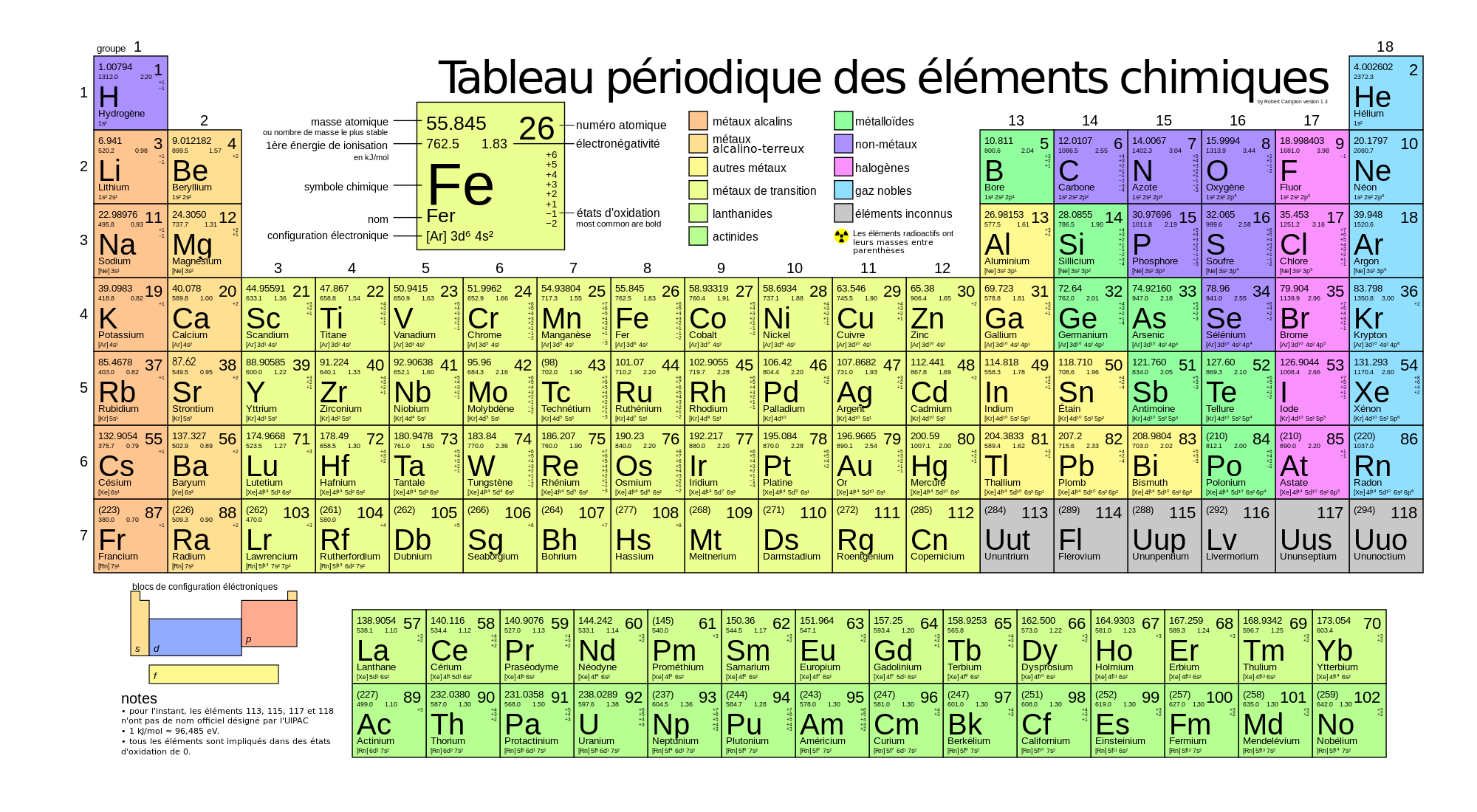
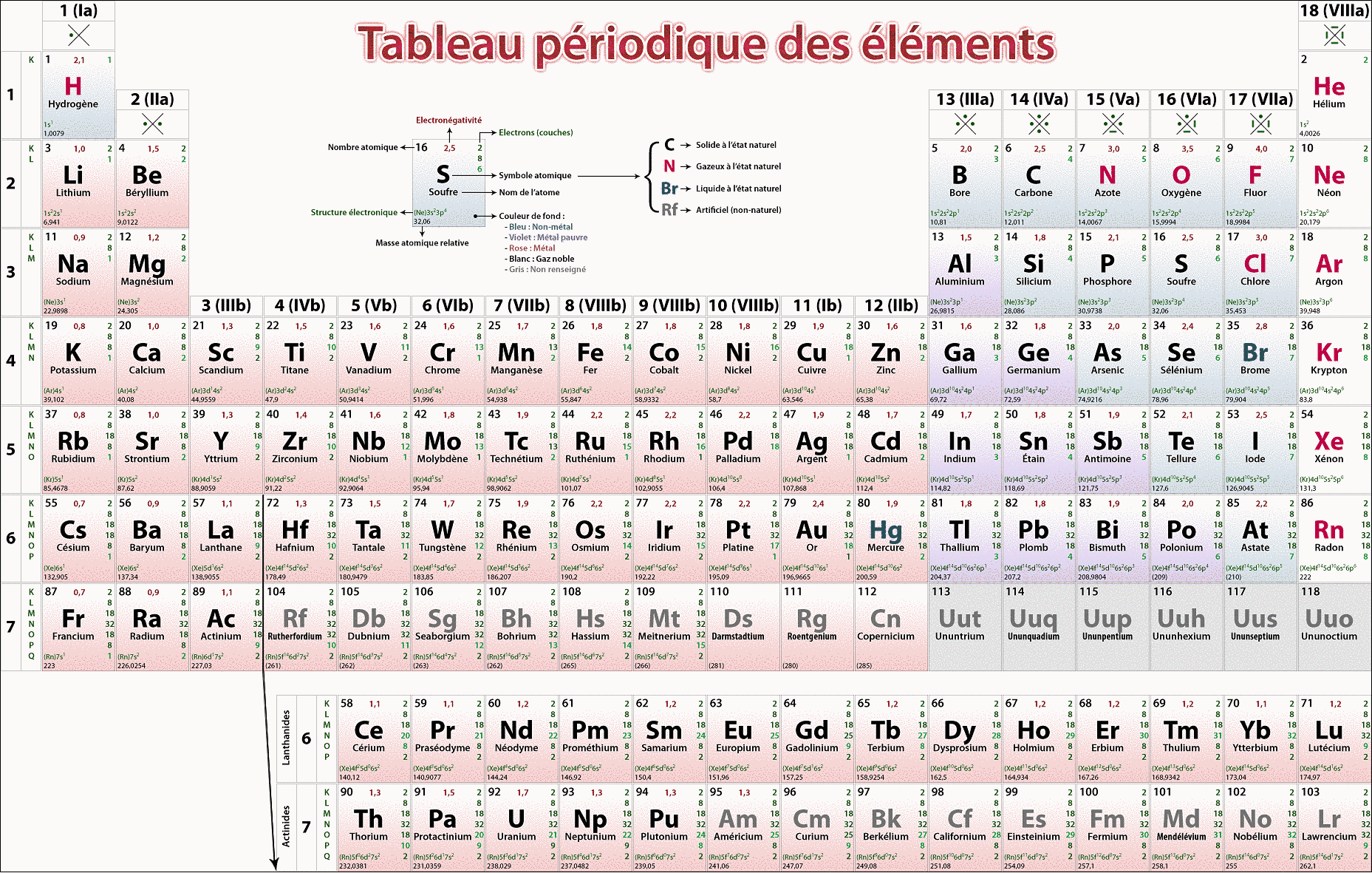
Voici donc un exposé détaillé sur le Tableau Périodique des Éléments classés par ordre alphabétique. Cette présentation, bien qu’inhabituelle, révèle des perspectives fascinantes sur l’organisation et les propriétés des éléments.
Nous allons explorer cet agencement singulier avec une précision rigoureuse. Préparez-vous à un voyage à travers les subtilités de la chimie et de la nomenclature.
L'Agencement Alphabétique : Un Nouveau Regard
Classer les éléments par ordre alphabétique modifie radicalement notre perception du tableau périodique. Les groupes traditionnels disparaissent. Les métaux alcalins ne côtoient plus les métaux alcalino-terreux. Les halogènes ne forment plus un bloc homogène.
Cette réorganisation permet de mettre en lumière des coïncidences inattendues et des disparités marquantes. Elle offre une nouvelle perspective sur les relations entre les noms des éléments et leurs propriétés intrinsèques.
Considérons, par exemple, l'élément Actinium. Son nom le place au début de la liste. Ses propriétés radioactives sont bien connues. Comparons-le à Zirconium, situé en fin de liste. Ce dernier est un métal résistant à la corrosion.
Cette juxtaposition révèle l'étendue de la diversité chimique représentée dans le tableau périodique.
Analyse Détaillée des Sections Alphabétiques
Étudions de plus près les sections alphabétiques du tableau. Nous observerons la distribution des métaux, des non-métaux et des métalloïdes. Nous examinerons également la répartition des gaz nobles et des éléments de transition.
La section commençant par la lettre "A" comprend l'Actinium, l'Aluminium, l'Américium, l'Antimoine, l'Argon, l'Arsenic et l'Astate. Cette diversité témoigne de la variété des propriétés chimiques associées à cette lettre.
La section "B" inclut le Baryum, le Berkélium, le Béryllium, le Bismuth, le Bohrium, le Bore et le Brome. On observe ici un mélange de métaux alcalino-terreux, de métalloïdes et d'halogènes.
Continuons avec la lettre "C". On y trouve le Cadmium, le Césium, le Calcium, le Californium, le Carbone, le Cérium, le Chlore, le Chrome, le Cobalt, le Copernicium et le Cuivre. Cette section illustre la richesse et la complexité de la chimie du carbone et des métaux de transition.
La section "D" comprend le Darmstadtium, le Dubnium et le Dysprosium. Ces éléments, moins communs, sont souvent utilisés dans des applications spécifiques en science des matériaux et en recherche nucléaire.
La section "E" est relativement courte, contenant l'Einsteinium, l'Erbium et l'Europium, tous des lanthanides aux propriétés magnétiques intéressantes.
La lettre "F" introduit le Fermium, le Fer, le Flerovium, le Fluor et le Francium. Le fer, élément essentiel à la vie, contraste avec le francium, un métal alcalin extrêmement rare et radioactif.
Passons à la lettre "G" : Gadolinium, Gallium, Germanium, Or (Gold en anglais) et le Gaz nobles que sont le Krypton. Le germanium, un métalloïde important pour l'électronique, côtoie l’or, un métal précieux depuis l'antiquité.
La section "H" est dominée par l'Hafnium et l'Hydrogène. L'hydrogène, l'élément le plus abondant de l'univers, se trouve associé à un métal de transition utilisé dans les alliages résistants à la corrosion.
La section "I" contient l'Indium et l'Iode. L'iode, un halogène essentiel pour la santé humaine, se différencie de l'indium, un métal utilisé dans les écrans tactiles.
La lettre "K" introduit le Potassium et le Krypton. Le potassium, un métal alcalin vital pour les fonctions cellulaires, partage cette section avec un gaz noble inerte.
La section "L" inclut le Lanthane, le Lawrencium, le Lithium, le Livermorium et le Lutécium. Le lithium, un métal alcalin léger utilisé dans les batteries, contraste avec le lawrencium, un actinide synthétique.
La section "M" regroupe le Magnésium, le Manganèse, le Meitnerium, le Mendeleevium, le Mercure, le Molybdène et le Moscovium. Le mercure, unique métal liquide à température ambiante, se distingue par ses propriétés physiques inhabituelles.
La section "N" contient le Néodyme, le Néon, le Neptunium, le Nickel, le Nihonium, le Niobium et l'Azote (Nitrogen en anglais). L'azote, un élément essentiel pour la vie, côtoie le néon, un gaz noble utilisé dans l'éclairage.
La section "O" est simple, avec seulement l'Oganesson et l'Oxygène. L'oxygène, indispensable à la respiration, contraste avec l'oganesson, un élément synthétique super-lourd.
La section "P" inclut le Palladium, le Phosphore, le Platine, le Plomb, le Plutonium, le Polonium, le Praseodymium, le Prométhium et le Protactinium. Le phosphore, crucial pour l'ADN et l'ATP, se distingue par ses nombreuses formes allotropiques.
La lettre "R" regroupe le Radium, le Radon, le Rhénium, le Rhodium, le Rubidium, le Ruthénium et le Rutherfordium. Le radon, un gaz radioactif, se trouve associé à des métaux de transition comme le rhodium et le ruthénium, utilisés en catalyse.
La section "S" comprend le Samarium, le Scandium, le Seaborgium, le Sélénium, le Silicium, l'Argent (Silver en anglais), le Sodium, le Strontium et le Soufre. Le silicium, pilier de l'industrie électronique, contraste avec le sodium, un métal alcalin réactif.
La section "T" inclut le Tantale, le Technétium, le Tellure, le Terbium, le Thallium, le Thorium, le Thulium, l'Étain (Tin en anglais), le Titane et le Tungstène. Le titane, un métal léger et résistant, se distingue par ses applications dans l'aérospatiale et la médecine.
La section "U" ne contient que l'Uranium. Cet élément, bien connu pour son utilisation dans l'énergie nucléaire, est un actinide aux propriétés complexes.
La section "V" est simple, avec le Vanadium. Cet élément, utilisé dans les alliages d'acier, se distingue par sa résistance à la corrosion.
La section "W" ne contient que le Tungstène (Wolfram en anglais), un métal ayant le point de fusion le plus élevé de tous les éléments.
La lettre "Y" introduit l'Ytterbium et l'Yttrium. Ces éléments, souvent utilisés dans les lasers et les aimants, sont des métaux de transition rares.
Enfin, la section "Z" ne contient que le Zinc et le Zirconium. Le zinc, essentiel pour la santé humaine et utilisé dans la galvanisation, contraste avec le zirconium, un métal résistant à la corrosion utilisé dans les réacteurs nucléaires.
Conclusion
Ce parcours alphabétique à travers le tableau périodique démontre que la chimie est une science riche et complexe. L'ordre alphabétique, bien que non conventionnel, offre une perspective nouvelle sur les éléments et leurs propriétés. Il nous invite à repenser les liens entre les noms, les symboles et les caractéristiques fondamentales de la matière.
Tableau périodique des éléments - scienceamusante.net
-
tableau périodique des éléments
-
tableau périodique des éléments chimiques
-
tableau périodique des éléments pdf
-
tableau périodique des éléments à imprimer
-
tableau périodique des éléments chimiques pdf
-
tableau périodique des éléments exercices
-
table périodique des éléments
-
classification périodique des éléments chimiques
-
classification périodique des éléments pdf
-
le tableau périodique des éléments