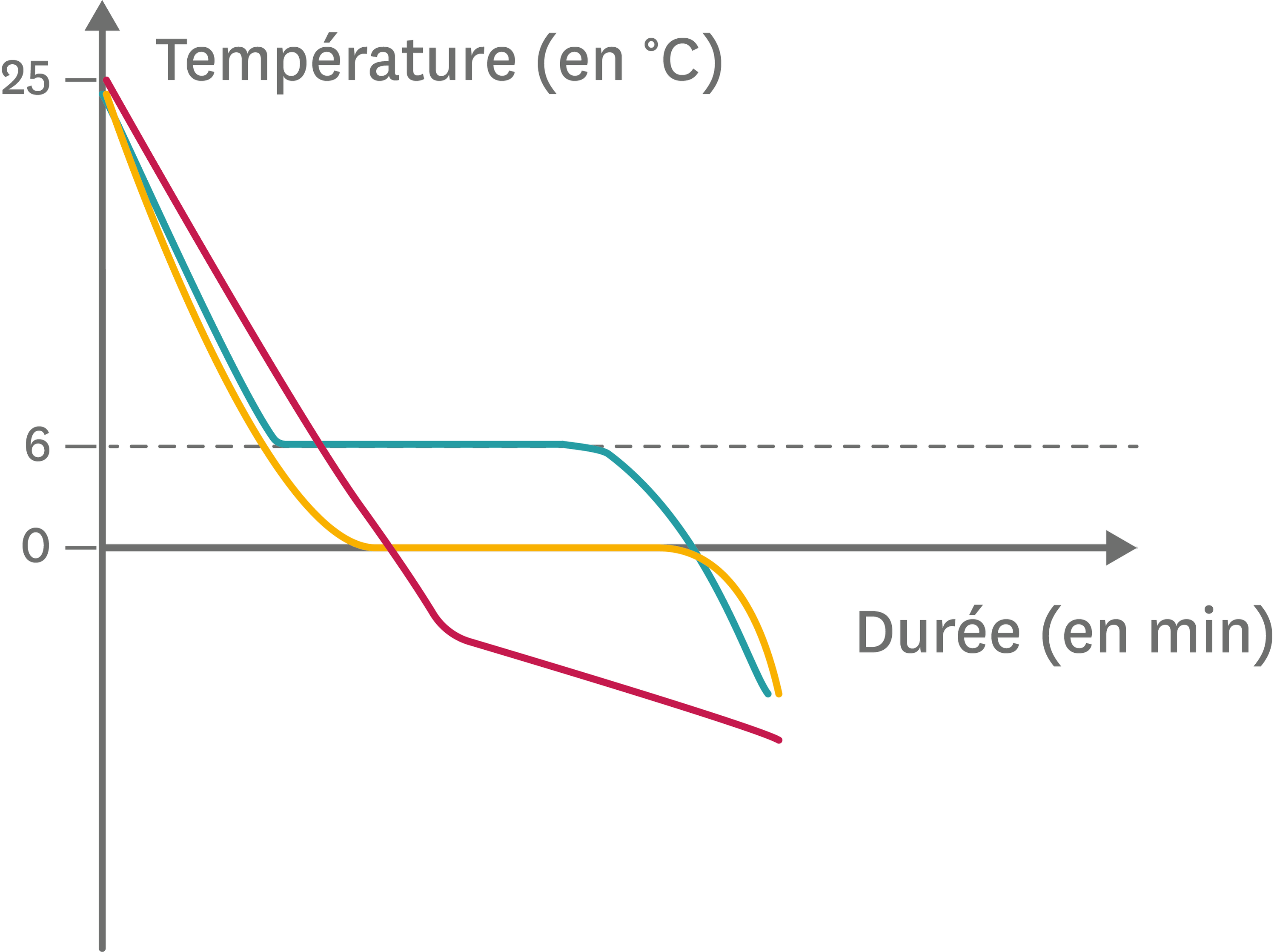
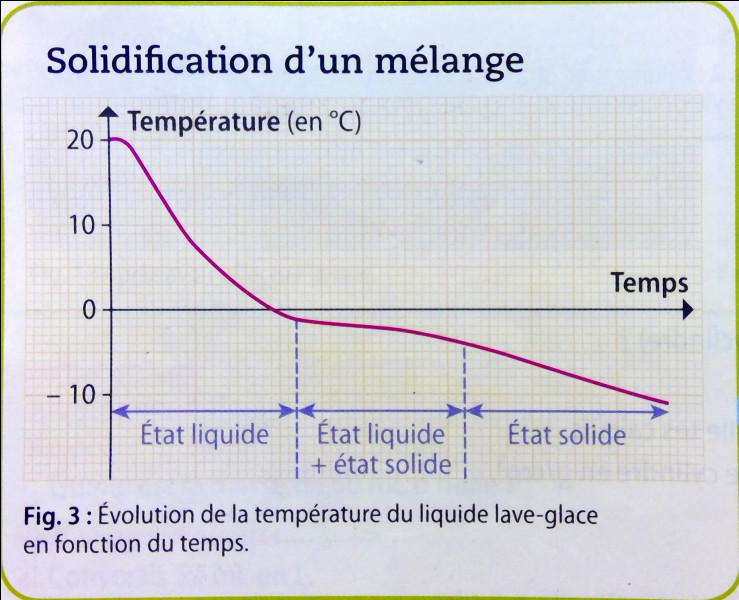
Lors d'un changement d'état, la température d'une substance pure reste constante. Cette constance est une observation fondamentale. Elle régit la manière dont l'énergie interagit avec la matière.
Observations Générales
Pendant la fusion de la glace, l'eau demeure à 0°C. Similairement, l'eau en ébullition maintient une température de 100°C. Cette invariance est vérifiable expérimentalement.
La température ne fluctue pas tant que la transition de phase est en cours. L'ajout de chaleur ne provoque pas d'augmentation de la température. Toute l'énergie est utilisée pour briser les liaisons intermoléculaires.
Explication Détaillée du Processus
La substance absorbe de l'énergie. Cette énergie est requise pour vaincre les forces attractives entre les molécules. Pendant la fusion, les molécules passent d'un état ordonné à un état plus désordonné. L'énergie fournie est la chaleur latente de fusion. Pendant l'ébullition, les molécules acquièrent une énergie cinétique suffisante pour échapper à la phase liquide. L'énergie correspondante est la chaleur latente de vaporisation.
La chaleur latente est une propriété intrinsèque de la substance. Sa valeur est spécifique à chaque transition de phase. Elle dépend de la nature des liaisons intermoléculaires. Plus les liaisons sont fortes, plus la chaleur latente est élevée.
L'énergie ajoutée est intégralement consacrée à la transition de phase. Elle ne contribue pas à augmenter l'énergie cinétique des molécules. L'énergie cinétique est directement liée à la température. Donc, la température reste stable.
Facteurs Influant sur la Température
La pression influence le point de fusion et d'ébullition. Une pression plus élevée augmente généralement ces points. Ce phénomène est décrit par la relation de Clausius-Clapeyron. La présence d'impuretés abaisse le point de fusion. Elle élève le point d'ébullition.
Il est crucial que la substance soit pure. Les mélanges présentent des comportements différents. Leurs transitions de phase se déroulent sur une plage de températures. La composition du mélange évolue pendant le changement d'état. Ceci explique la variation de température.
Mesures et Précautions
Un calorimètre permet de mesurer la chaleur latente. Des thermocouples de précision assurent un suivi précis de la température. Il est impératif d'isoler le système pour minimiser les pertes de chaleur.
Le contrôle de la pression est essentiel. Il faut maintenir une pression constante pendant l'expérience. L'agitation favorise l'homogénéisation de la température. Cela assure une transition de phase uniforme.
Applications Pratiques
Les changements d'état sont exploités dans de nombreux domaines. La réfrigération repose sur l'évaporation et la condensation de fluides frigorigènes. La climatisation utilise des cycles thermodynamiques similaires. Les échangeurs de chaleur transfèrent de l'énergie grâce aux changements de phase.
La cuisine utilise la fusion et la solidification pour créer des textures variées. La métallurgie exploite la fusion pour la fabrication d'alliages. La distillation sépare des liquides en fonction de leurs points d'ébullition.
Exceptions et Cas Particuliers
Certaines substances présentent des transitions de phase complexes. Le soufre possède plusieurs allotropes avec des points de fusion différents. L'eau présente un comportement anormal. Sa densité maximale est à 4°C. Le point de fusion de la glace diminue avec l'augmentation de la pression.
Les transitions vitreuses ne sont pas de vrais changements d'état. Elles se produisent dans les matériaux amorphes. La température évolue progressivement. Il n'y a pas de chaleur latente définie.
Conclusion
La stabilisation de la température lors d'un changement d'état est un phénomène fondamental. Elle obéit à des lois thermodynamiques précises. La compréhension de ce phénomène est cruciale. Elle est importante pour de nombreuses applications scientifiques et techniques. Des mesures précises et un contrôle rigoureux des paramètres sont nécessaires. Ceci pour observer et exploiter ce phénomène efficacement.
Exercice thermodynamique : Chaleur et changement d'état physique de la
-
stabilisation de la température lors d'un changement d'état
-
stabilisation de la température lors d'un changement d'état en 6 lettres
-
stabilisation de la temperature lors d un changement d etat
-
zone de stabilisation de la température lors d un changement d état