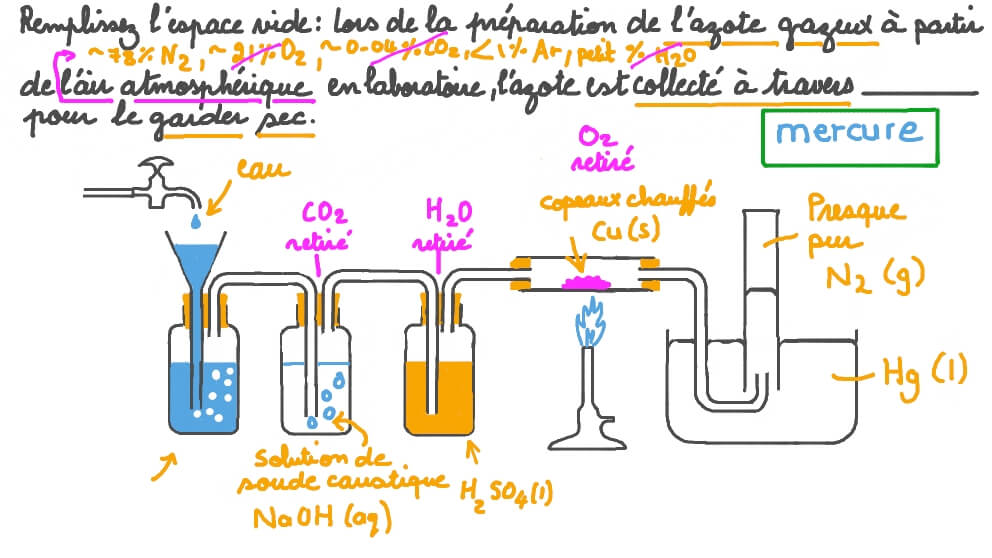
L'azote, un élément omniprésent et essentiel, se manifeste sous différentes formes selon la température à laquelle il est exposé. Sa transition vers l'état gazeux est un phénomène précis, régi par des lois thermodynamiques rigoureuses. Nous allons explorer les subtilités de ce processus.
L'azote pur, dans des conditions normales de pression atmosphérique, se présente sous forme gazeuse. Ce gaz incolore et inodore constitue environ 78 % de l'atmosphère terrestre. Sa transition vers un état liquide ou solide nécessite des températures extrêmement basses.
Le point d'ébullition de l'azote est précisément de -195,79 °C (soit 77,36 K ou -320,42 °F). C'est à cette température exacte, sous une pression standard de 1 atmosphère (101,325 kPa), que l'azote liquide commence à se transformer en gaz.
La transition de phase n'est pas instantanée. À mesure que la température augmente au point d'ébullition, l'azote absorbe de l'énergie sous forme de chaleur latente de vaporisation. Cette énergie est nécessaire pour vaincre les forces d'attraction intermoléculaires qui maintiennent les molécules d'azote à l'état liquide.
Durant cette phase de transition, la température demeure constante jusqu'à ce que tout l'azote liquide soit converti en gaz. Une fois la vaporisation complète, toute augmentation de température supplémentaire se traduit par une augmentation de l'énergie cinétique des molécules de gaz, entraînant une augmentation de leur vitesse et de leur agitation.
Il est crucial de noter que le point d'ébullition de l'azote est sensible à la pression. Une augmentation de la pression élèvera le point d'ébullition, tandis qu'une diminution de la pression le réduira. Cette relation est décrite par l'équation de Clausius-Clapeyron, qui relie la variation de la pression de vapeur d'une substance à la température et à l'enthalpie de vaporisation.
Dans des applications industrielles, l'azote liquide est souvent stocké et transporté dans des conteneurs cryogéniques spécialement conçus. Ces conteneurs, tels que les Dewars, sont isolés thermiquement afin de minimiser le transfert de chaleur de l'environnement extérieur vers l'azote liquide, réduisant ainsi le taux d'évaporation.
L'azote gazeux est utilisé dans une multitude d'applications. Il sert de gaz inerte pour prévenir l'oxydation dans divers procédés industriels. Il est également utilisé pour pressuriser des systèmes, pour la conservation des aliments, et dans la fabrication de composants électroniques.
L'utilisation de l'azote liquide pour le refroidissement est également très répandue. Sa capacité à absorber de grandes quantités de chaleur lors de sa vaporisation en fait un fluide frigorigène efficace. On l'utilise notamment dans la cryoconservation d'échantillons biologiques, le refroidissement de matériel électronique et dans certaines applications médicales.
La sublimation de l'azote solide, bien que moins courante dans les applications quotidiennes, est également un phénomène important. L'azote solide, à une température de -210,01 °C (soit 63,14 K), peut se transformer directement en gaz sans passer par la phase liquide. Ce processus, appelé sublimation, requiert une énergie encore plus importante que la vaporisation.
La connaissance précise du point d'ébullition et des transitions de phase de l'azote est essentielle dans de nombreux domaines scientifiques et industriels. La maîtrise de ces propriétés permet d'optimiser les processus, d'assurer la sécurité et d'innover dans divers secteurs.
En conclusion, la température à laquelle l'azote passe à l'état gazeux est un paramètre physique bien défini et crucial. La compréhension approfondie de ce phénomène est indispensable pour son utilisation efficace et sécurisée dans une variété d'applications. Le point d'ébullition précis de -195,79 °C, combiné à la connaissance des effets de la pression et des transitions de phase, permet de manipuler et d'utiliser l'azote dans ses différentes formes avec précision et contrôle.
Les conditions de vie sur Terre - TPE : La vie humaine ailleurs
-
la température à laquelle l'azote passe à l'état gazeux
-
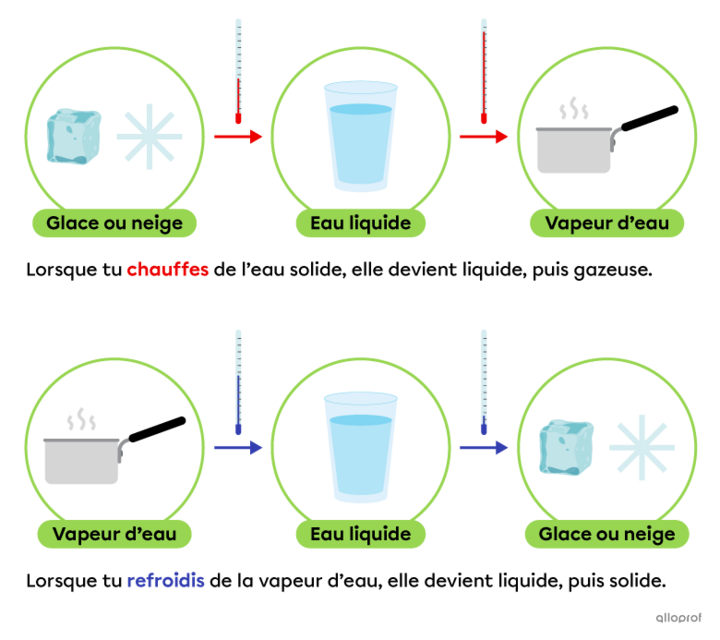
la température à laquelle l'eau se transforme en glace
-
quelle est la température à laquelle l eau se transforme en glace