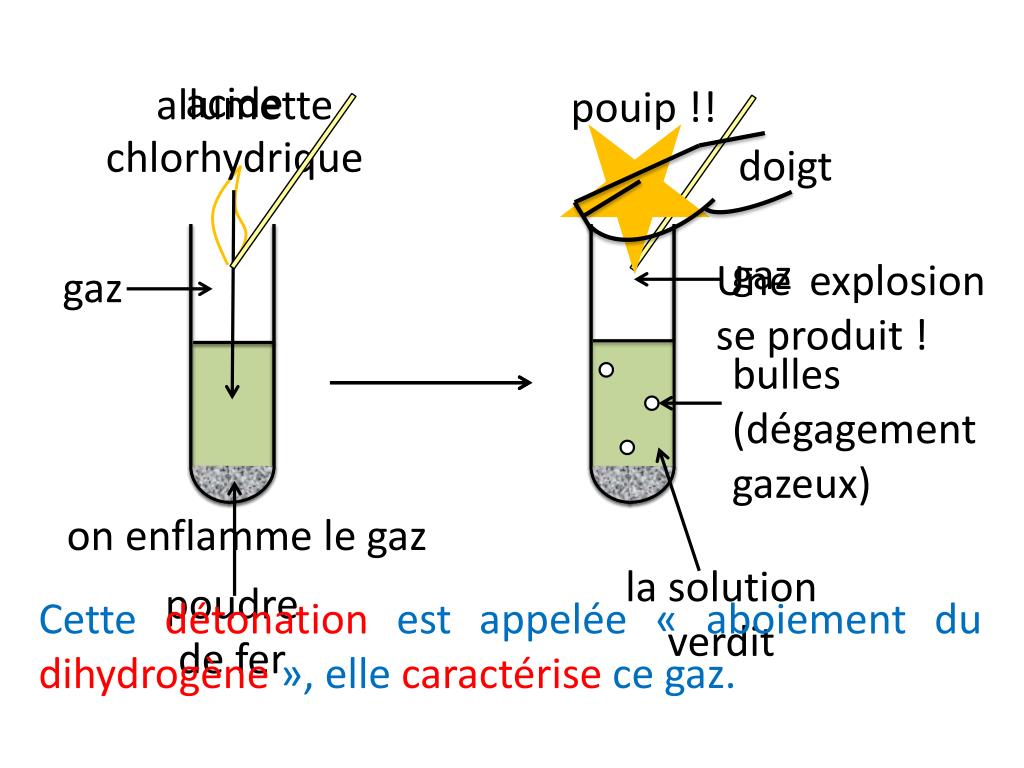
L'acide chlorhydrique (HCl) réagit avec le fer (Fe) pour former du chlorure de fer(II) (FeCl2) et du dihydrogène (H2). Cette réaction est une réaction d'oxydoréduction.
L'équation chimique équilibrée est : Fe(s) + 2 HCl(aq) → FeCl2(aq) + H2(g).
Le fer métallique est oxydé. Il perd deux électrons pour former l'ion fer(II). Son nombre d'oxydation passe de 0 à +2. Fe → Fe2+ + 2e-.
L'ion hydrogène de l'acide chlorhydrique est réduit. Il gagne un électron pour former du dihydrogène. Son nombre d'oxydation passe de +1 à 0. 2 H+ + 2e- → H2.
Le chlorure (Cl-) est un ion spectateur. Il ne participe pas à la réaction d'oxydoréduction.
La réaction est exothermique. Elle libère de la chaleur. L'énergie d'activation est relativement faible.
La vitesse de la réaction dépend de plusieurs facteurs. La concentration de l'acide chlorhydrique en est un. Plus l'acide est concentré, plus la réaction est rapide. La température influence aussi la vitesse. Une température plus élevée accélère la réaction. La surface de contact du fer joue un rôle important. Une surface plus grande augmente la vitesse de réaction.
Le fer doit être propre. La présence d'une couche d'oxyde à sa surface ralentit la réaction. Le décapage du fer est donc souvent nécessaire.
La pureté du fer a également un impact. Les impuretés peuvent agir comme catalyseurs ou inhibiteurs.
Le chlorure de fer(II) est soluble dans l'eau. Il se dissout dans la solution. La solution devient verdâtre.
Le dihydrogène est un gaz incolore et inodore. Il est inflammable. Il est plus léger que l'air. Des bulles de gaz se dégagent de la solution.
La réaction peut être utilisée pour produire du dihydrogène. Elle est utilisée dans certaines applications industrielles. Elle est aussi utilisée dans des expériences de laboratoire.
La réaction peut être affectée par la présence d'autres métaux. Par exemple, la présence de zinc peut conduire à une réaction compétitive. Le zinc réagit avec l'acide chlorhydrique plus facilement que le fer.
Le potentiel standard de réduction du fer(II) est -0,44 V. Le potentiel standard de réduction de l'ion hydrogène est 0,00 V. La différence de potentiel entre les deux demi-réactions est positive. Cela indique que la réaction est spontanée dans les conditions standard.
La réaction est susceptible de produire des vapeurs d'acide chlorhydrique. La manipulation doit être effectuée sous une hotte aspirante. Le port de lunettes de protection et de gants est recommandé.
La corrosion du fer en présence d'acide chlorhydrique est un problème courant. Des inhibiteurs de corrosion peuvent être ajoutés à l'acide chlorhydrique. Ces inhibiteurs réduisent la vitesse de la corrosion.
La concentration du chlorure de fer(II) peut être déterminée par titrage. On utilise une solution de permanganate de potassium comme titrant. La réaction entre le permanganate de potassium et le fer(II) est une réaction d'oxydoréduction.
L'ion fer(II) peut être complexé avec des ligands. Cela peut modifier la vitesse de la réaction. Cela peut aussi modifier la couleur de la solution.
Le fer(III) peut également être présent dans la solution. Il peut provenir de l'oxydation du fer(II) par l'oxygène de l'air. La présence de fer(III) modifie la couleur de la solution.
L'équation ionique nette est : Fe(s) + 2 H+(aq) → Fe2+(aq) + H2(g).
Le mécanisme de la réaction implique plusieurs étapes. L'adsorption des ions hydrogène à la surface du fer est une étape clé. Le transfert d'électrons du fer aux ions hydrogène est une autre étape importante.
La réaction est influencée par le pH de la solution. Un pH plus bas favorise la réaction.
L'état de surface du fer a une influence significative. Un fer poli réagit différemment d'un fer rouillé.
La présence d'oxygène peut compliquer la réaction. L'oxygène peut oxyder le fer en fer(II) ou en fer(III).
L’équation peut être ajustée pour prendre en compte la formation de différents produits de corrosion. Par exemple, Fe(OH)2 ou FeOOH peuvent se former.
Le dégagement de dihydrogène peut être mesuré pour déterminer la vitesse de la réaction. Ceci peut se faire à l'aide d'un dispositif de collecte de gaz.
La réaction du fer avec l'acide chlorhydrique est un exemple classique de réaction acide-métal. Elle est utilisée dans de nombreuses applications scientifiques et industrielles.
La cinétique de la réaction peut être étudiée en mesurant la concentration des réactifs ou des produits en fonction du temps. Des méthodes spectroscopiques peuvent être utilisées pour déterminer les concentrations.
L'étude de cette réaction est essentielle pour comprendre les phénomènes de corrosion. Elle permet de développer des stratégies pour protéger les métaux contre la corrosion.
La réaction est un excellent exemple pour illustrer les concepts d'oxydation et de réduction. Elle est souvent utilisée dans l'enseignement de la chimie.
PPT - Réaction entre l’acide chlorhydrique et le fer PowerPoint
-
équation de la réaction entre l'acide chlorhydrique et le fer
-
équation de la réaction entre le cuivre et l'acide nitrique
-
équation de la réaction entre le diiode et les ions thiosulfate
-
équation de la réaction
-
équation de la réaction entre l'acide lactique et l'eau
-
équation de la réaction entre l'aluminium et l'acide chlorhydrique
-
équation de la réaction de saponification
-
équation de la réaction chimique
-
équation de la réaction d'autoprotolyse de l'eau
-
équation de la réaction support du titrage

+Bilan+de+cette+réaction:.jpg)




