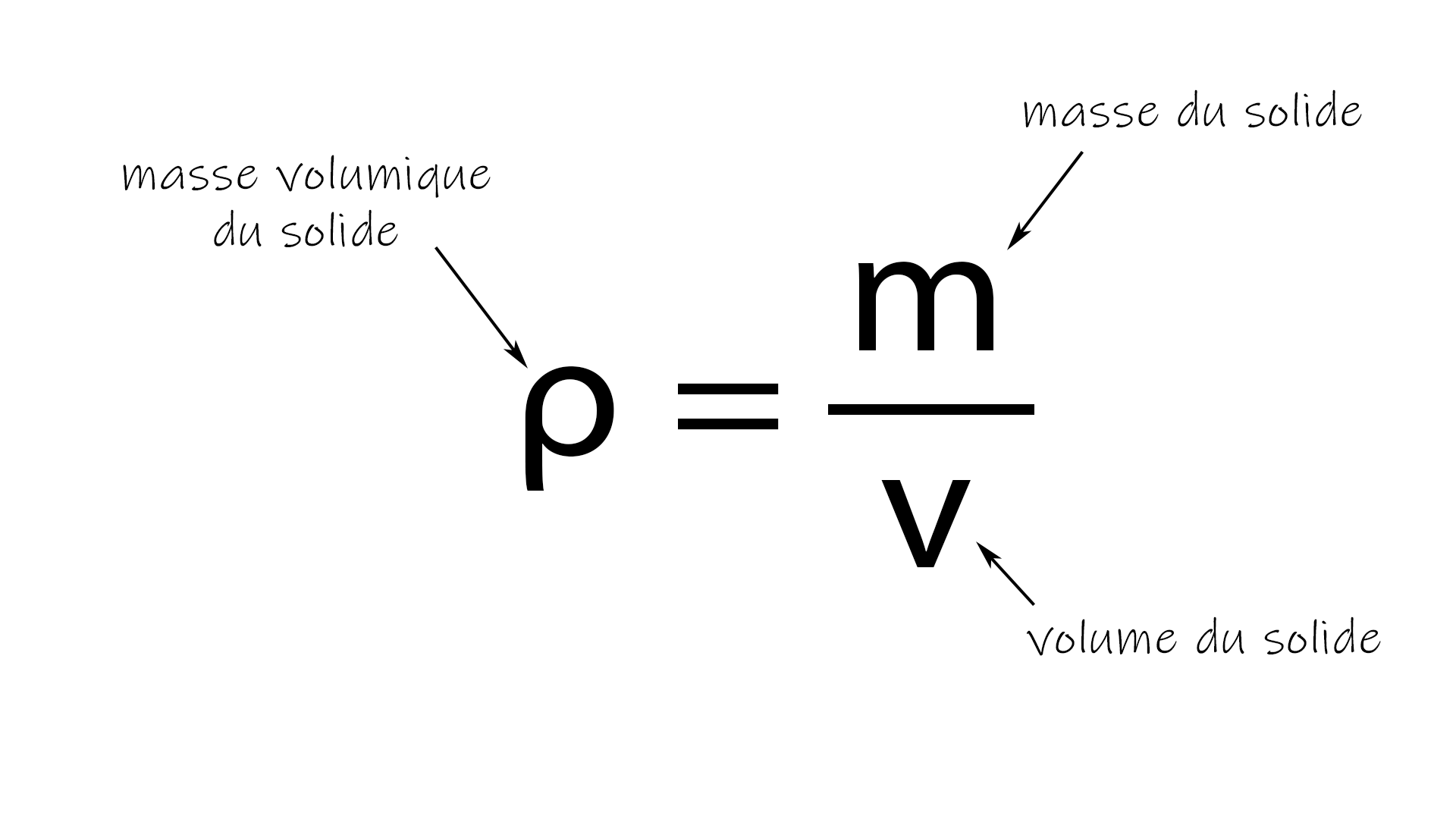La masse volumique et la concentration en masse sont deux propriétés physiques distinctes. Elles décrivent la quantité de matière dans un volume donné, mais elles s'appliquent à des situations différentes. La masse volumique concerne une substance pure. La concentration en masse concerne un mélange.
Distinction Fondamentale
La masse volumique (ρ) est une propriété intrinsèque d'une substance. Elle représente la masse d'une substance par unité de volume. Elle est exprimée en kg/m³ (kilogrammes par mètre cube) ou g/cm³ (grammes par centimètre cube).
La concentration en masse (Cm) est une propriété d'un mélange. Elle représente la masse d'un soluté par unité de volume de solution. Elle est exprimée en g/L (grammes par litre) ou kg/m³.
Masse Volumique : Une Propriété Intrinsèque
La masse volumique d'une substance pure est constante à une température et une pression données. Elle ne dépend pas de la quantité de substance. Elle est une caractéristique spécifique de chaque matériau.
Elle est calculée par la formule : ρ = m/V, où 'm' est la masse et 'V' est le volume. Elle est une propriété intensive.
Exemples :
- La masse volumique de l'eau pure à 4°C est d'environ 1000 kg/m³.
- La masse volumique du fer est d'environ 7874 kg/m³.
- La masse volumique de l'air est d'environ 1.225 kg/m³ au niveau de la mer à 15°C.
La température et la pression affectent la masse volumique. Une augmentation de la température entraîne généralement une diminution de la masse volumique (expansion). Une augmentation de la pression entraîne généralement une augmentation de la masse volumique (compression).
Concentration en Masse : Une Propriété d'un Mélange
La concentration en masse décrit la quantité d'une substance (soluté) dissoute dans une autre (solvant). Elle est spécifique à un mélange donné. Elle peut varier en fonction de la quantité de soluté ajouté.
Elle est calculée par la formule : Cm = m(soluté) / V(solution), où 'm(soluté)' est la masse du soluté et 'V(solution)' est le volume de la solution. Elle est une propriété intensive.
Exemples :
- Une solution saline à 10 g/L contient 10 grammes de sel par litre de solution.
- Une solution de sucre à 50 g/L contient 50 grammes de sucre par litre de solution.
La concentration en masse peut être exprimée en différentes unités. Les plus courantes sont g/L, mg/L, kg/m³, ppm (parties par million).
Différences Clés Résumées
| Caractéristique | Masse Volumique (ρ) | Concentration en Masse (Cm) | | ------------------------- | ----------------------------------------------------- | ---------------------------------------------------------- | | Domaine d'application | Substance pure | Mélange (solution) | | Ce qu'elle mesure | Masse par unité de volume de la substance | Masse du soluté par unité de volume de la solution | | Dépendance de la quantité | Indépendante (propriété intrinsèque) | Dépendante (varie selon la composition du mélange) | | Formule | ρ = m/V | Cm = m(soluté) / V(solution) | | Unités typiques | kg/m³, g/cm³ | g/L, kg/m³, ppm |
Implications et Applications
La masse volumique est utilisée pour identifier des matériaux. Elle est aussi utilisé dans les calculs de flottabilité. Elle intervient aussi dans la conception de structures.
La concentration en masse est utilisée en chimie, en biologie, et en ingénierie. Elle est utilisée pour préparer des solutions. Elle est aussi utilisée pour analyser la composition des mélanges. Elle sert aussi à contrôler la qualité des produits.
Exemples Concrets
Imaginez un bloc de fer pur. Sa masse volumique sera constante. Elle ne dépend pas de la taille du bloc.
Maintenant, imaginez que vous dissolvez du sel dans de l'eau. La concentration en masse de la solution saline dépendra de la quantité de sel ajoutée à l'eau. Plus vous ajoutez de sel, plus la concentration en masse sera élevée. La masse volumique de la solution saline change aussi avec l'ajout de sel, mais elle reflète la masse de l'ensemble de la solution (eau + sel) par unité de volume, et non seulement la masse du sel.
Conclusion
Bien que liées par le concept de masse et de volume, la masse volumique et la concentration en masse représentent des informations fondamentalement différentes. La première caractérise une substance pure, tandis que la seconde décrit la composition d'un mélange. Distinguer ces deux concepts est essentiel pour une compréhension précise de la physique et de la chimie.
Lien entre concentration molaire et concentration massique - YouTube
-
difference entre masse volumique et concentration en masse
-
difference entre masse volumique absolue et apparente
-
différence entre masse volumique et densité
-
différence entre masse volumique et concentration massique
-
difference entre masse volumique et concentration
-
différence entre masse volumique et volume
-
difference entre masse volumique et concentration massique
-
différence entre masse volumique réelle et apparente
-
difference entre masse volumique et volume
-
difference entre masse volumique et volume massique