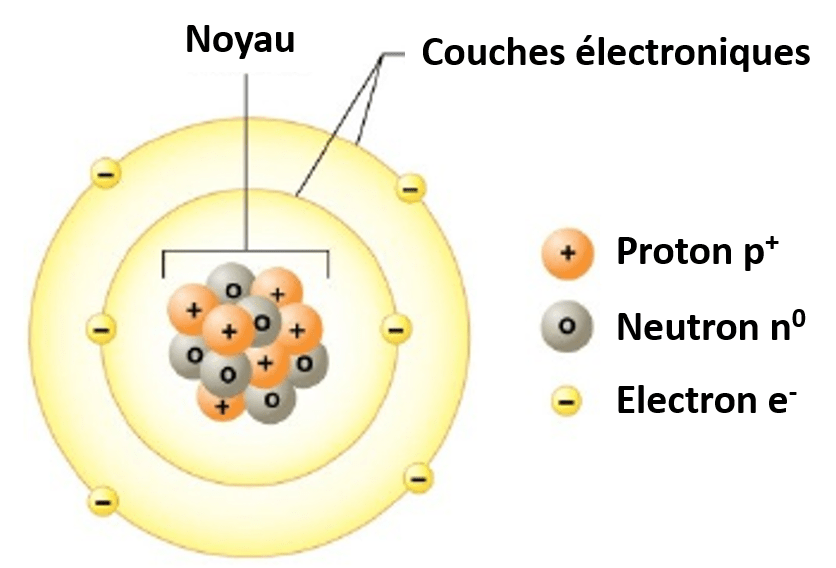
Absolument. Deux atomes du même élément peuvent tout à fait posséder des noyaux différents. Cette différence réside dans le nombre de neutrons.
Isotopes : Variations Nucléaires
Les atomes d'un même élément ayant un nombre différent de neutrons sont appelés isotopes. Le nombre de protons, lui, reste constant. C'est ce nombre de protons qui définit l'élément.
Prenons l'hydrogène. L'hydrogène "ordinaire", ou protium, possède un seul proton et aucun neutron. Le deutérium, un autre isotope de l'hydrogène, possède un proton et un neutron. Le tritium, encore un autre isotope, a un proton et deux neutrons. Ces trois formes sont toutes de l'hydrogène, car elles ont toutes un proton.
Le carbone illustre également ce phénomène. Le carbone 12 (¹²C) est l'isotope le plus abondant. Il possède 6 protons et 6 neutrons. Le carbone 13 (¹³C) possède 6 protons et 7 neutrons. Le carbone 14 (¹⁴C) possède 6 protons et 8 neutrons. Ils sont tous du carbone.
Chaque élément possède plusieurs isotopes. Leur abondance varie considérablement. Certains isotopes sont stables. D'autres sont radioactifs.
Stabilité Nucléaire et Radioactivité
La stabilité d'un noyau dépend du rapport entre le nombre de protons et le nombre de neutrons. Un rapport déséquilibré peut rendre le noyau instable. Ces noyaux instables subissent une désintégration radioactive.
Le carbone 14 est un isotope radioactif du carbone. Il se désintègre avec une demi-vie d'environ 5730 ans. Cette désintégration est utilisée pour la datation au carbone 14.
L'uranium possède également des isotopes radioactifs importants, comme l'uranium 235 et l'uranium 238. L'uranium 235 est fissile. Il peut subir une fission nucléaire en chaîne. C'est ce qui est utilisé dans les centrales nucléaires et les armes nucléaires.
Impact des Isotopes
Les isotopes d'un élément ont des masses différentes. Cette différence de masse affecte légèrement les propriétés physiques de l'élément. La vitesse de diffusion et de réaction peut varier.
En chimie, l'effet isotopique cinétique est important. Il permet de comprendre les mécanismes réactionnels. Les isotopes lourds réagissent plus lentement que les isotopes légers.
En médecine, les isotopes radioactifs sont utilisés pour l'imagerie médicale. Le technétium-99m est un isotope radioactif très utilisé. Il permet de visualiser différents organes.
En géochimie, les rapports isotopiques sont utilisés pour déterminer l'âge des roches. Ils permettent de reconstituer l'histoire de la Terre.
Les isotopes stables sont également utilisés comme traceurs. Ils permettent de suivre le devenir des éléments dans les systèmes biologiques et environnementaux. Par exemple, l'azote 15 est utilisé pour étudier le cycle de l'azote.
Séparation Isotopique
La séparation des isotopes est un processus complexe. Elle est nécessaire pour obtenir des isotopes purs. Différentes méthodes sont utilisées.
La diffusion gazeuse est une méthode utilisée pour séparer les isotopes de l'uranium. L'enrichissement de l'uranium repose sur cette technique.
La centrifugation est une autre méthode. Elle utilise la différence de masse entre les isotopes. Les isotopes les plus lourds se concentrent à la périphérie du centrifugeur.
La séparation électromagnétique est une méthode plus précise. Elle utilise un champ magnétique pour dévier les ions des différents isotopes.
La séparation par laser est une méthode plus récente. Elle utilise des lasers pour exciter sélectivement les atomes d'un isotope particulier.
En conclusion, la diversité isotopique est une caractéristique fondamentale des éléments. Elle a des implications importantes dans de nombreux domaines. De la datation à l'imagerie médicale, en passant par la recherche fondamentale, les isotopes sont des outils précieux. Leur étude continue de faire progresser nos connaissances.
5.2 La formation de composés p À lire… La section en haut de la page
-
deux atomes du même élément peuvent-ils avoir des noyaux différents